Урок 08. Тепловой расчёт камеры. Способ второй — лирический (ч.4)
 Приветствую Вас, друзья, на очередном уроке по расчёту камер ЖРД.
Приветствую Вас, друзья, на очередном уроке по расчёту камер ЖРД.
Мы продолжаем рассматривать особенности теплового расчёта и сегодня поговорим о том, как определить температуру продуктов сгорания в камере сгорания.
Если помните, при определении парциальных давлений газов мы задавались тремя значениями температуры в окрестности ожидаемой. Однако мы так и не выяснили, каково же её действительное значение. Для определения температуры можно использовать уравнение сохранения энергии, выраженной через энтальпии топлива и продуктов сгорания. Т.е., согласно этому закону можно утверждать, что полная энтальпия топлива равна полной энтальпии продуктов сгорания на входе в сопло при температуре, равной температуре газов в камере сгорания. Полную энтальпию топлива мы с Вами считать уже умеем. Если что-то подзабылось, вернитесь к уроку 3. Остаётся дело за малым — определить полную энтальпию продуктов сгорания при «не очень известной» температуре.
Здесь нам на помощь опять придут справочные данные. Значения полной энтальпии для простейших газов, таких как CO₂, H₂O, NO и пр., в зависимости от температуры известны и занесены в справочники. Посмотреть их можно, например, здесь. Конечно, возникает некоторая сложность, связанная с тем, что значения энтальпии приведены только для вполне конкретных температур, и её промежуточные значения нужно как-то определить. Здесь существует два пути: с помощью интерполяции находить промежуточные значения, вычислять полную энтальпию смеси и сравнивать с энтальпией топлива, либо можно выбрать значения для трёх заданных нами ранее температур, опять же вычислить полную энтальпию для этих трёх точек и построить по ним сглаживающий график. Затем графическим путём определить температуру, соответствующую полной энтальпии топлива. Точность такого способа определения оказывается вполне приемлемой для тепловых расчётов (единицы Кельвинов), к тому же он, на мой взгляд, более удобен и не лишён некоторого изящества 🙂 .
Для вычисления полной энтальпии продуктов сгорания воспользуемся формулой
![]()
Здесь Mi — молярная масса i-го газа в кг/кмоль, численно равная относительной молекулярной массе.
Продолжим расчёт камеры на основе НДМГ+АТ, несколько отложенный в сторону с позапрошлого урока. Состав продуктов сгорания для Т1 = 3300 К; Т₂ = 3400 К; Т3 = 3500 К мы посчитали. Определим полную энтальпию продуктов сгорания для этих температур.
Выпишем значения энтальпий составляющих газов и занесём их в таблицу. Также для удобства подсчитаем произведения энтальпий и молярных масс на соответствующие парциальные давления.
Т1 = 3300 К
| pN2 | pCO2 | pCO | pH2 | pH2O | pOH | pNO | pH | pO2 | pO | pN | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Iп i , МДж кмоль |
104,1 | -221,0 | -5,655 | 100,2 | -100,6 | 143,2 | 197,0 | 280,6 | 110,4 | 310,7 | 420,9 | |
| Mi , кг кмоль |
28 | 44 | 28 | 2 | 18 | 17 | 30 | 1 | 32 | 16 | 14 | |
| pi , кПа |
1743 | 548,6 | 813,5 | 408,7 | 2156 | 151,7 | 43,95 | 73,97 | 39,10 | 19,15 | 2,205 | ∑pi = 6000 кПа |
| Iп i·pi | 181446 | -121241 | -4600 | 40952 | -216894 | 21723 | 8658 | 20756 | 4317 | 5950 | 928 | ∑Iп i·pi = =-58004 |
| Mi·pi | 48804 | 24138 | 22778 | 817 | 38808 | 2579 | 1319 | 74 | 1251 | 306 | 31 | ∑Mi·pi = =140906 |
Таким образом полная энтальпия при Т1 = 3300 К
![]()
Аналогично поступаем для двух других температур.
Т₂ = 3400 К
| pN2 | pCO2 | pCO | pH2 | pH2O | pOH | pNO | pH | pO2 | pO | pN | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Iп i , МДж кмоль |
107,9 | -214,6 | -1,910 | 103,9 | -95,09 | 147,0 | 200,8 | 282,7 | 114,4 | 312,8 | 423,0 | |
| Mi , кг кмоль |
28 | 44 | 28 | 2 | 18 | 17 | 30 | 1 | 32 | 16 | 14 | |
| pi , кПа |
1716 | 504,7 | 841,8 | 434,1 | 2067 | 193,6 | 57,08 | 97,53 | 55,31 | 29,94 | 3,248 | ∑pi = 6000 кПа |
| Iп i·pi | 185156 | -108309 | -1608 | 45103 | -196551 | 28459 | 11462 | 27572 | 6327 | 9365 | 1374 | ∑Iп i·pi = =8351 |
| Mi·pi | 48048 | 22207 | 23570 | 868 | 37206 | 3291 | 1712 | 98 | 1770 | 479 | 45 | ∑Mi·pi = =139295 |
Полная энтальпия при Т₂ = 3400 К
![]()
Т3 = 3500 К
| pN2 | pCO2 | pCO | pH2 | pH2O | pOH | pNO | pH | pO2 | pO | pN | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Iп i , МДж кмоль |
111,6 | -208,3 | 1,840 | 105,8 | -89,59 | 150,8 | 204,6 | 284,8 | 118,5 | 314,9 | 425,1 | |
| Mi , кг кмоль |
28 | 44 | 28 | 2 | 18 | 17 | 30 | 1 | 32 | 16 | 14 | |
| pi , кПа |
1684 | 457,2 | 870,8 | 464,4 | 1962 | 239,6 | 71,40 | 127,2 | 73,50 | 44,68 | 4,672 | ∑pi = 6000 кПа |
| Iп i·pi | 187934 | -95235 | 1602 | 49134 | -175776 | 36132 | 14608 | 36227 | 8710 | 14070 | 1986 | ∑Iп i·pi = =79392 |
| Mi·pi | 47152 | 20117 | 24382 | 929 | 35316 | 4073 | 2142 | 127 | 2352 | 715 | 65 | ∑Mi·pi = =137371 |
Полная энтальпия при Т3 = 3500 К
![]()
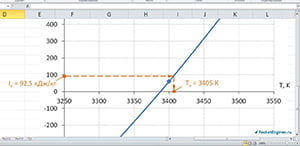
Построим график и, отложив на оси ординат величину энтальпии топлива, найдём температуру продуктов сгорания. Как видно на рисунке, Тк ≈ 3405 К.
Аналогично посчитаем молярную массу продуктов сгорания для трёх температур по формуле
![]()
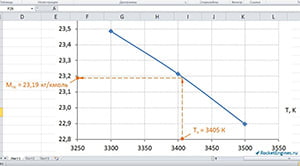
Значения числителя и знаменателя записаны в таблицах. Подставляем в формулу и получаем МПС1 = 23,49 кг/кмоль, МПС2 = 23,21 кг/кмоль, МПС3 = 22,90 кг/кмоль.
Строим график (см. рис.) и графически определяем для найденной температуры 3405 К значение молярной массы продуктов сгорания. МПС ≈ 23,19 кг/кмоль.
Также, нам понадобится газовая постоянная продуктов сгорания
![]()
Напоминаю, что Rμ = 8,314 кДж/(кмоль·К) — универсальная газовая постоянная.
На сегодня всё. Продолжим в следующем уроке.
Всем удачи!
| « | Урок 07. Тепловой расчёт камеры. Способ второй — лирический (ч.3) | Урок 09. Тепловой расчёт камеры. Способ второй — лирический (ч.5) | » |