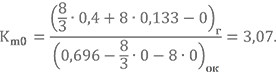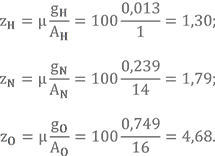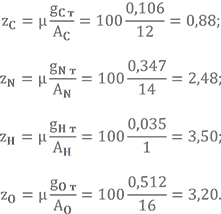Урок 02. Определение параметров топлива (ч.1)
 Здравствуйте!
Здравствуйте!
В сегодняшнем уроке мы узнаем, как определить стехиометрическое соотношение компонентов и записать условную химическую формулу топлива.
Итак, начнём.
Во-первых, давайте вспомним, что же это такое – стехиометрическое соотношение компонентов топлива. Оказывается, топливо может гореть по-разному. Причем не нужно воспринимать это горение как обычное горение дров в камине, где в качестве окислителя выступает кислород воздуха. Горение топлива в камере ракетного двигателя — это, в первую очередь, химическая реакция окисления с выделением тепла. А протекание химических реакций существенно зависит от того, сколько вещества вступает в реакцию. Если взять 1 кг какого-нибудь горючего и заставить его взаимодействовать с очень большим количеством окислителя, то после того, как этот 1 кг горючего закончится, химическая реакция горения прекратится, потому что окислителю просто нечего будет окислять.
Вопрос на засыпку.
На защите курсового проекта у студента спрашивают: что произойдёт с горючим, впрыскиваемым через пояс завесного охлаждения перед критическим сечением камеры? Распространённый ответ: оно сгорит. Это неверно. Ему не с чем там гореть. Весь окислитель уже прореагировал в камере сгорания. Горючее испарится, может разложиться, но сгореть не может.
Значит, для каждой топливной пары существует вполне определённое соотношение между количеством окислителя и горючего, при котором они взаимодействуют друг с другом без остатка. Именно такое соотношение называют стехиометрическим.
Количество компонента можно задать объёмом или массой. При расчёте топлив больше распространено массовое соотношение компонентов Km (индекс m как раз и указывает на это). Для обозначения стехиометрического соотношения добавляют индекс 0, т.е. — Km0. Каждая топливная пара имеет вполне определённое Km0. Его можно найти в справочной литературе. Однако в учебно-познавательных целях давайте рассмотрим, как его можно вычислить.
Значение Km0 зависит от валентности, которую могут проявлять химические элементы в теоретической форме уравнения химической реакции
![]()
Ну начинается — скажете Вы — опять формулы. Ну, куда же без них. На самом деле, если разобраться, то как бы и ничего сложного:
μок и μг — молекулярные массы окислителя и горючего (мы их уже считали в прошлом уроке);
bi — число грамм-атомов химического элемента в веществе, т.е. фактически количество атомов в химической формуле (грамм-атом — устаревшая единица измерения количества вещества);
νi — валентность элемента (νH = +1, νC = +4, νN = 0, νO = -2).
Пример
Возьмём топливную пару НДМГ + АТ и вычислим для неё Km0. Молекулярную массу НДМГ и АТ мы уже считали:
μ(C2N2H8) = 12·2 + 14·2 + 1·8 = 60 а.е.м.
μ(N2O4) = 14·2 + 16·4 = 92 а.е.м.Количество атомов и валентности элементов известны. Подставляем в формулу
Но это наиболее общая формула. Она годится для любых веществ, но неудобна, если компонент представляет собой смесь. Придётся дополнительно определять его условную химическую формулу чтобы узнать bi.
Для определения Km0 при сгорании углеводородных топлив в учебнике Штехера, например, предлагается использовать более практичную формулу (для веществ, содержащих только C, H, N, O)
проститутки ярославля самые дешевые. услуги по сварке аргоном, l в тольятти.
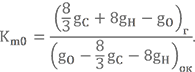
Пример
Найдём стехиометрическое соотношение компонентов для той же топливной пары НДМГ + АТ, но по другой формуле.
Массовые доли элементов в НДМГ были найдены в прошлом уроке gC = 0,400, gN = 0,467, gH = 0,133.
Для азотного тетраоксида gN = 0,304, gO = 0,696 (предлагаю Вам посчитать их самостоятельно).Подставляем
Вроде бы сошлось. 🙂
Если Вам всё же больше нравится первый вариант, то компонент нужно представить в виде условной химической формулы. При этом задаться условной молекулярной массой смеси (например, μ = 100 а.е.м.).
Количество атомов в формуле можно определить так:
![]()
Пример
Определим условную химическую формулу АК-20, рассмотренного в прошлом уроке.
Массовые доли gH = 0,013, gN = 0,239, gO = 0,749.
В итоге получаем: H1,30N1,79O4,68.
Получить условную химическую формулу топлива можно тем же способом.
Для определения массовых долей компонентов в топливе в целом нужно знать действительное соотношение компонентов Km. Прежде чем его вычислить, скажем несколько слов о такой величине, как коэффициент избытка окислителя αок.
Несмотря на то, что казалось бы сжигать компоненты при стехиометрии наиболее выгодно, по ряду причин реальные ЖРД обычно работают с некоторым избытком горючего (рассказ о причинах займёт довольно много времени, возможно этому вопросу будет посвящена отдельная статья в Базе знаний). Для различия между стехиометрическим и действительным соотношением компонентов топлива и вводится αок.
Зависимость крайне проста
![]()
Коэффициент может принимать любые положительные значения. Если αок = 1, Km = Km0, при αок < 1 топливо имеет избыток горючего, при αок> 1 — избыток окислителя.
Узнать наперед какое значение αок лучше выбрать, очень сложно. Поэтому им либо задаются из диапазона рекомендуемых значений, либо проводят серию тепловых расчетов при разных αок, а затем выбирают оптимальное, например, из условия максимума скорости истечения продуктов сгорания на срезе сопла.
Зная значение коэффициента избытка окислителя, можно определить массовый состав топлива:
![]()
Пример
Определим массовый состав топливной пары НДМГ + АТ при αок = 0,91 и запишем её условную химическую формулу.
Значение Km0 получено в примерах выше. Массовые доли химических элементов в компонентах тоже уже известны.
Проверяем
Количество атомов в условной химической формуле
И наконец, сама формула — C0,88N2,48H3,50O3,20.
На этом всё. Надеюсь, урок был полезным. В следующий раз поговорим об энтальпии топлива и плотности смесей.
Желаю всем всего хорошего!
| « | Урок 01. Определение массового состава топливных компонентов | Урок 03. Определение параметров топлива (ч.2) | » |