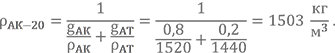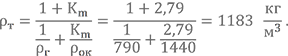Урок 03. Определение параметров топлива (ч.2)
 У меня сейчас вечер, если у Вас тоже, добрейший Вам вечерочек! Если же Вы читаете этот урок не вечером, то наверно у Вас экзамен, и Вы зашли на сайт со своего смартфона чтобы что-то подсмотреть. Удачи! 🙂
У меня сейчас вечер, если у Вас тоже, добрейший Вам вечерочек! Если же Вы читаете этот урок не вечером, то наверно у Вас экзамен, и Вы зашли на сайт со своего смартфона чтобы что-то подсмотреть. Удачи! 🙂
Сегодня у нас по плану энтальпия топлива и плотность смесей. Давайте начнём.
Сначала немного поговорим о самом понятии — энтальпия. Не вдаваясь в глубокие дебри, сразу скажу, что энтальпия — это энергия. Если Вы, как сейчас говорят, погуглите в инете, то найдёте определения самых разных видов энтальпий. Среди прочих нас будет интересовать термодинамическая энтальпия и энтальпия сгорания.
Термодинамическая энтальпия это количество энергии, затраченной на образование вещества из исходных химических элементов. Для веществ, состоящих из одинаковых молекул (H₂, O₂ и пр.), она равна нулю.
Энтальпия сгорания имеет смысл только при условии протекания химической реакции. Для разных веществ и реакций существуют экспериментально полученные при нормальных условиях значения этой величины. Чаще всего для горючих это полное окисление в среде кислорода, для окислителей — окисление водорода заданным окислителем. Причем значения могут быть как положительными, так и отрицательными в зависимости от вида реакции.
Сумму термодинамической энтальпии и энтальпии сгорания называют полной энтальпией вещества. Собственно этой величиной и оперируют при тепловом расчёте камер ЖРД.
Узнать значения энтальпий топливных компонентов можно в справочной литературе или, например, в этом разделе. Обращаю Ваше внимание, что говоря в нашем случае об энтальпии, мы имеем в виду удельную энтальпию, т.е. количество энергии, отнесенное к единице массы. Единица измерения — Дж/кг.
Где взять энтальпию отдельных веществ мы выяснили. Но, как мы знаем, часто компоненты являются смесью 2-х, а иногда и более веществ. Как подсчитать энтальпию такого компонента? Дело тут осложняется тем, что при смешивании веществ происходит растворение одного вещества в другом. При растворении может выделяться или поглощаться тепло, и эту тепловую энергию необходимо учитывать. С другой стороны дело упрощается, потому что в инженерных расчетах обычно учитывают только теплоту растворения воды в некоторых веществах.
В ниже приведенной таблице как раз и указана теплота растворения воды Qр в этих некоторых веществах.
| Вещество | Qр, кДж/кг |
|---|---|
| Азотная кислота | -1360 |
| Перекись водорода | -46 |
| Этиловый спирт | -59 |
В общем случае энтальпия компонента, состоящего из нескольких веществ, может быть посчитана по формуле
![]()
Давайте разберёмся, что здесь что. Энтальпию каждого из веществ умножаем на соответствующую ему массовую долю, и всё складываем. Затем теплоту растворения каждого из веществ в других также умножаем на соответствующую массовую долю и тоже складываем. И наконец, складываем сумму энтальпий и сумму теплот растворения. Запутанно получилось. На практике всё проще, т.к. учитываем только растворение воды. Смотрим пример.
Пример
Найдём энтальпию 96% азотной кислоты. Состав: HNO3 — 96%, H₂O — 4%.
Смотрим в справочные данные. I(HNO3) = -2764 кДж/кг, I(H2O) = -15880 кДж/кг. Теплота растворения воды в азотной кислоте согласно таблице Qр (HNO3) = -1360 кДж/кг.
Подставляем в формулу
Как видите, в итоге очень простые вычисления.
Осталось посчитать энтальпию топлива по формуле, которая очень похожа на расчёт массовых долей.
![]()
Пример
Вычислим энтальпию уже знакомой нам топливной пары НДМГ + АТ при Km = 2,79.
Смотрим в справочник или идём по ссылке и выписываем значения энтальпий топливных компонентов: IНДМГ = 828 кДж/кг и IАТ = -207 кДж/кг.
Подставляем и путём нехитрых вычислений получаем результат
Ну а теперь, как и обещал, несколько слов о плотности.
Плотности веществ — величины известные, и особых трудностей работа с ними вызывать не должна. Однако, как всегда, ситуацию несколько портят топливные компоненты, являющиеся механическими смесями. Посмотрим, как можно определить плотность компонента в этом случае.
Конечно же, для этого тоже есть формула, и выглядит она так
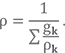
Думаю должно быть всё понятно. Если не очень, смотрите пример ниже.
Сразу приведём формулу для расчёта общей плотности топлива
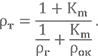
Пример
Не будем ничего особо выдумывать и найдём плотность АК-20.
Состав и свойства этого компонента мы уже не раз смотрели в таблице физических свойств компонентов.
Ещё пример
Определим плотность топлива НДМГ + АТ при Km = 2,79.
Итак, в сегодняшнем уроке мы разобрались в том, что такое энтальпия и как её посчитать. А также научились определять плотность сложных компонентов и топлива в целом.
Этим уроком я завершаю небольшой раздел по определению физических и энергетических свойств топлив. На следующем уроке будем начинать изучать очень большой и трудоёмкий термодинамический расчёт камеры. Но не пугайтесь — дорогу осилит идущий.
А на сегодня всё. Всего Вам хорошего!
| « | Урок 02. Определение параметров топлива (ч.1) | Урок 04. Тепловой расчёт камеры. Способ первый — быстрый | » |