Урок 09. Тепловой расчёт камеры. Способ второй — лирический (ч.5)
 Здравствуйте, уважаемые друзья!
Здравствуйте, уважаемые друзья!
Сегодня, как видите, уже 5-я часть нашего повествования о тепловом расчёте камеры ЖРД, а мы ещё не закончили определение параметров в камере сгорания. И это при том, что впереди ещё срез сопла и желательно критика. Как видите, объём вычислений достаточно велик, и выполнять его вручную — несколько трудоёмкое занятие. Но, как мы с Вами уже договаривались, цель наших уроков – не получить какой-то результат, а на конкретном примере изучить содержательную часть термодинамического расчёта и понять логические связи при определении тех или иных величин.
Итак, меньше слов — больше дела. На сегодня я запланировал определение энтропии и состава продуктов сгорания при найденной на прошлом уроке температуре.
Вы скажете, уже ж определяли состав, к тому же полученная температура (3405 К) не сильно отличается от одной из трёх (3400 К), для которой состав нам известен. Ну, во-первых, то, что не сильно отличается, это нам просто повезло, а во-вторых, нужно всё-таки полностью решить задачу. Поэтому, соберём волю в кулак 🙂 и, применяя графический метод, определим точный состав газовой смеси. Он нам ещё понадобится в будущем для вычисления теплоёмкости и вязкости продуктов сгорания при расчёте проточного охлаждения.
А зачем нужна энтропия? Более подробно расскажу на следующем уроке, когда будем рассматривать срез сопла. Сейчас скажу только, что при переходе к срезу сопла нам понадобится «энергетическая связка» между параметрами в камере сгорания и на срезе.
Итак, давайте с неё (т.е. с энтропии) и начнём. Принцип графического определения тот же самый, что и для энтальпии, а вот формула немного мудрёнее.
Сдать металлолом с вывозом на сайте http://www.vcm-lom.ru.
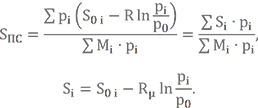
Здесь S0i — энтропия i-го газа при определённой температуре, приведённая к единице количества вещества, р0 — давление газа при нормальных условиях, т.е. р0 = 101325 Па. Величина S0 — справочная. Если не хотите терять время в поисках необходимой книги, на сайте в Справочных материалах есть соответствующий раздел.
Покажем порядок вычисления энтропии при температуре 3300 К на примере газа CO₂
Из таблицы выписываем S0 CO2 = 340,6 кДж/(кмоль·K). Универсальная газовая постоянная Rμ = 8,314 кДж/(кмоль·K). Парциальное давление pCO2 = 548,6 кПа. (Не запутайтесь, в одну формулу подставляйте величины давлений в одинаковых единицах). Нормальное давление окружающей среды p0 = 101,3 кПа.
Вычисляем энтропию для наших трёх температур. Выписываем значения энтропии, заносим величины в таблицы. Результат можно увидеть ниже.
Т1 = 3300 К
| CO₂ | H₂O | CO | H₂ | N₂ | OH | NO | O₂ | H | O | N | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S0i , кДж кмоль·K |
340,6 | 291,0 | 277,6 | 206,5 | 270,5 | 260,5 | 291,9 | 288,5 | 164,7 | 211,7 | 203,3 | |
| Mi , кг кмоль |
44 | 18 | 28 | 2 | 28 | 17 | 30 | 32 | 1 | 16 | 14 | |
| pi , кПа |
548,6 | 2156 | 813,5 | 408,7 | 1743 | 151,7 | 44,0 | 39,1 | 74,0 | 19,2 | 2,2 | ∑pi = 6000 кПа |
| Si·pi | 179148 | 572506 | 211738 | 79657 | 430321 | 39009 | 13120 | 11590 | 12381 | 4308 | 517 | ∑Si·pi = =1554294 |
| Mi·pi | 24138 | 38803 | 22778 | 817 | 48812 | 2579 | 1317 | 1251 | 74 | 306 | 31 | ∑Mi·pi = =140906 |
Вычисляем энтропию при Т1 = 3300 К
![]()
Т₂ = 3400 К
| CO₂ | H₂O | CO | H₂ | N₂ | OH | NO | O₂ | H | O | N | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S0i , кДж кмоль·K |
342,5 | 292,6 | 278,7 | 207,6 | 271,6 | 261,6 | 293,0 | 289,7 | 165,3 | 212,4 | 204,0 | |
| Mi , кг кмоль |
44 | 18 | 28 | 2 | 28 | 17 | 30 | 32 | 1 | 16 | 14 | |
| pi , кПа |
504,7 | 2067 | 841,8 | 434,1 | 1716 | 193,6 | 57,1 | 55,3 | 97,5 | 29,9 | 3,2 | ∑pi = 6000 кПа |
| Si·pi | 166121 | 552926 | 219790 | 84867 | 425671 | 49603 | 17002 | 16299 | 16148 | 6654 | 745 | ∑Si·pi = =1555827 |
| Mi·pi | 22207 | 37202 | 23570 | 868 | 48045 | 3291 | 1713 | 1770 | 98 | 478 | 45 | ∑Mi·pi = =139288 |
Энтропия при Т₂ = 3400 К
![]()
Т3 = 3500 К
| CO₂ | H₂O | CO | H₂ | N₂ | OH | NO | O₂ | H | O | N | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S0i , кДж кмоль·K |
344,3 | 294,2 | 279,8 | 208,7 | 272,7 | 262,7 | 294,1 | 290,8 | 165,9 | 213,0 | 204,6 | |
| Mi , кг кмоль |
44 | 18 | 28 | 2 | 28 | 17 | 30 | 32 | 1 | 16 | 14 | |
| pi , кПа |
457,2 | 1962 | 870,8 | 464,4 | 1684 | 239,6 | 71,4 | 73,5 | 127,2 | 44,7 | 4,7 | ∑pi = 6000 кПа |
| Si·pi | 151685 | 528982 | 228075 | 91041 | 419897 | 61228 | 21206 | 21570 | 20862 | 9825 | 1082 | ∑Si·pi = =1555453 |
| Mi·pi | 20117 | 35323 | 24382 | 929 | 47155 | 4073 | 2142 | 2352 | 127 | 715 | 66 | ∑Mi·pi = =137381 |
Энтропия при Т3 = 3500 К
![]()
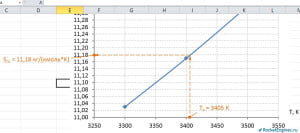
Строим график и производим уже знакомые манипуляции.
Таким образом, SПС ≈ 11,18 кДж/(кг·К).
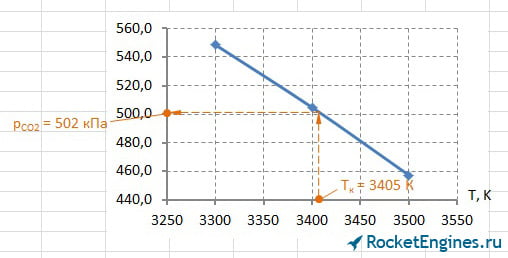
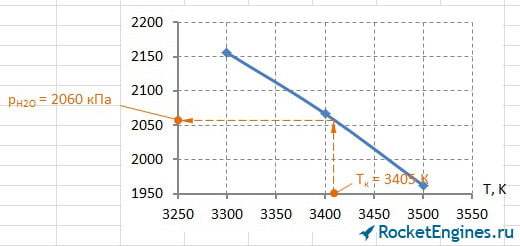
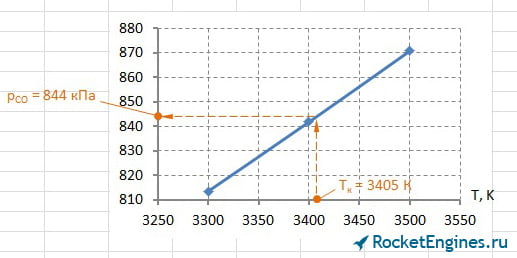
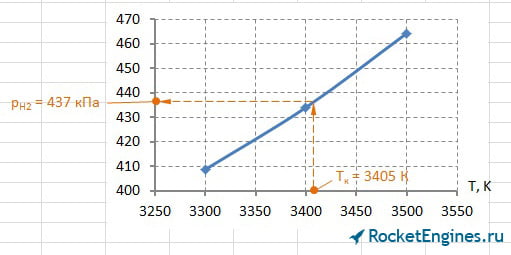
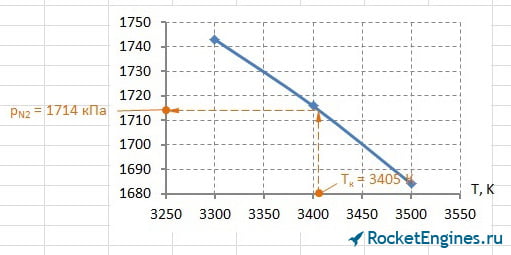
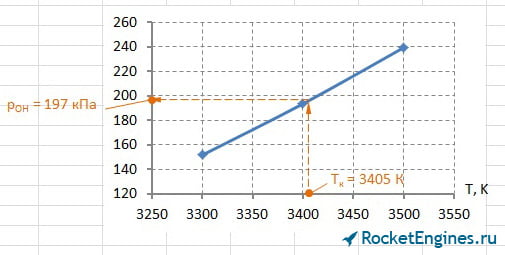
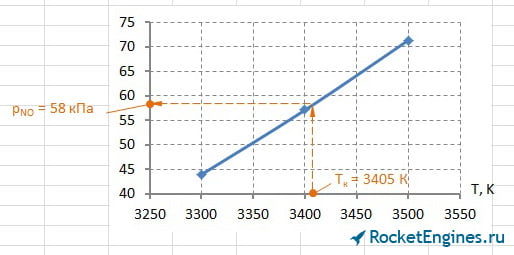
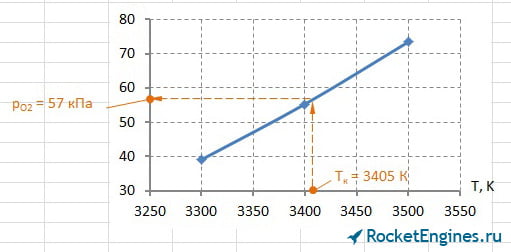
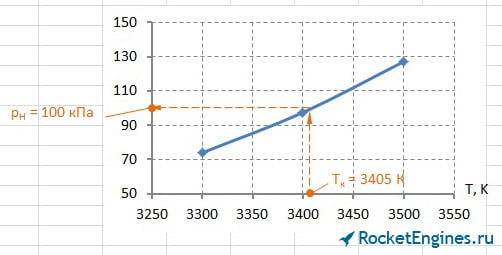
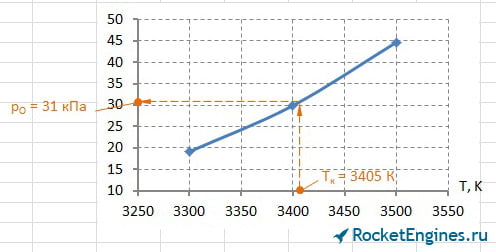
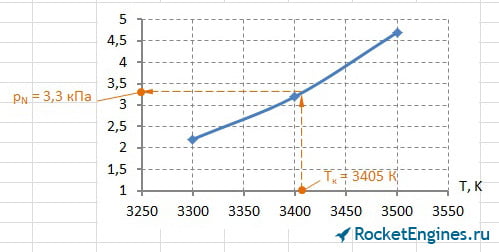
Теперь перейдём к парциальным давлениям. Для каждого давления придётся построить график, из которого найти соответствующее значение. Особо расписывать уже ничего не буду, ниже просто приведу соответствующие рисунки.
Составим таблицу парциальных давлений для Т = 3405 К.
| pCO2 | pH2O | pCO | pH2 | pN2 | pOH | pNO | pO2 | pH | pO | pN | pi , кПа |
502 | 2060 | 844 | 437 | 1714 | 197 | 58 | 57 | 100 | 31 | 3,3 |
|---|
Пожалуй, всё на сегодня. На следующем уроке займёмся срезом сопла.
Всем удачи! Если Вам понравилось, не забывайте рассказывать о нас своим знакомым 🙂
| « | Урок 08. Тепловой расчёт камеры. Способ второй — лирический (ч.4) | Урок 10. Тепловой расчёт камеры. Способ второй — лирический (ч.6) | » |