Урок 01. Определение массового состава топливных компонентов
 Здравствуйте, друзья!
Здравствуйте, друзья!
Данным уроком я хочу начать серию статей, посвящённых расчёту камер ЖРД. В первую очередь для того, чтобы помочь студентам соответствующих специальностей самостоятельно выполнить все расчёты, необходимые для последующего проектирования.
Итак, в исходном задании к курсовому проекту Вам задана топливная пара, или, может быть, Вы обосновали её выбор самостоятельно, выполняя дипломный проект. Так или иначе, Вам необходимо знать, сколько же это топливо сможет при сгорании выделить тепла (тепловой энергии), которое потом в камере ЖРД будет преобразовано в движение газовой струи.
Чтобы в последующем посчитать энтальпию топлива (раньше её называли теплосодержанием) нам нужно знать какие химические элементы и в каком количестве содержатся в заданном топливе, т.е. нужно знать состав топлива. Для этого, конечно же, необходимо обратиться к химическим формулам горючего и окислителя. Узнать какая формула у Вашего компонента можно, например, здесь. Обратите внимание, что в составе указанных веществ обычно присутствуют не более трёх из четырёх указанных далее химических элементов. Это углерод (C), водород (H), кислород (O) и азот (N).
Состав топлива выражают в долях. Доли могут быть разные — массовые или объёмные. В литературе Вы можете ещё встретить название мольные доли. Это в принципе то же самое, что и объёмные (во всяком случае, численно). Состав топливных компонентов обычно выражают в массовых долях.
В качестве топлив ЖРД применяются вещества, имеющие разную физико-механическую структуру. Это могут быть индивидуальные вещества, вещества со сложным физико-химическим составом (смесь различных углеводородов, типичный пример — керосин), а также механические смеси двух и более топливных компонентов.
Разберём все эти варианты.
1. Топливный компонент представляет собой индивидуальное вещество. Это значит, что оно состоит исключительно из одних и тех же молекул и может быть задано обычной химической формулой. (Например: тетраоксид азота — N₂O4, несимметричный диметилгидразин (НДМГ) — C₂N₂H8 или вода — H₂O).
В этом случае массовая доля i-го химического элемента в веществе рассчитывается по формуле:
![]()
Буквы здесь нехитрые:
Ai — относительная атомная масса i-го химического элемента; zi — количество атомов в химической формуле; μ — относительная молекулярная масса всего вещества.
Примечание: относительная молекулярная масса численно совпадает с молярной массой вещества, выраженной в кг/кмоль. Эти величины легко перепутать. Однако, в большинстве случаев имеет значение отношение масс, поэтому ошибка в вычислениях маловероятна.
Пример
Рассчитаем массовые доли содержания химических элементов в НДМГ. Химическая формула — C₂N₂H8.
Сначала подсчитаем молекулярную массу. Вспомним относительные атомные массы из таблицы Менделеева: углерод (C) — 12, водород (H) — 1, кислород (O) — 16, азот (N) — 14. Атомов углерода у нас 2, азота — 2 и водорода — 8.
Следовательно, μ(C2N2H8) = 12·2 + 14·2 + 1·8 = 60 а.е.м.
Ну и массовые доли считаем по приведенной выше формуле (рекомендуемая точность до 3-го знака после запятой)
Правильность расчётов проверяем, складывая массовые доли. Их сумма должна быть равна 1 (возможна погрешность в 3-м знаке после запятой).
2. Топливный компонент сложный по составу и задан условной химической формулой. Это означает, что в одном веществе присутствуют «разные» молекулы, и выразить количество атомов в формуле целым числом невозможно. Кроме того, для такого вещества задают и условную молекулярную массу. Обычно принимают μ = 100 а.е.м. Расчёт массовых долей выполняют по прежней формуле.
Козловой кран купить у завода.
Пример
Найдем массовые доли содержания химических элементов в керосине. Условная химическая формула C7,21H13,29.
Проверка
3. Топливный компонент представляет собой механическую смесь индивидуальных веществ. Т.е., если взять и смешать два или более вещества, то в такой смеси будут присутствовать два или более типов молекул в определенной пропорции. Формула для расчёта несколько усложняется, но принципиально не изменяется
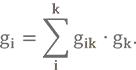
Не пугайтесь, gik — это все та же массовая доля, формула для которой нам уже знакома, а gk — доля содержания индивидуального вещества в смеси. Например, АК-27 содержит 27% N₂O4 и 73% HNO3, т.е. g(N2O4) = 0,27 и g(HNO3) = 0,73.
Думаю, следующий пример внесет ясность.
Пример
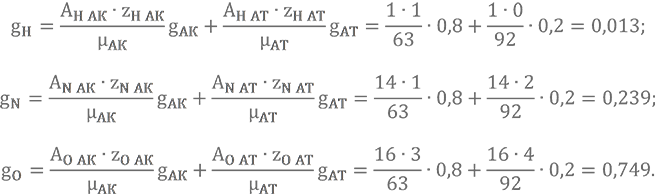
Подсчитаем массовые доли содержания химических элементов в окислителе АК-20. Состав АК-20 — 20% N₂O4 и 80% HNO3.
Для начала
μ(N2O4) = 14·2 + 16·4 = 92 а.е.м.
μ(HNO3) = 1·1 + 14·1 + 16·3 = 63 а.е.м.
g(N2O4) = 0,20 и g(HNO3) = 0,80.Обозначим для краткости записи АК — азотная кислота, АТ — азотный тетраоксид.
Подставляем в формулу
Обратите внимание, в тетраоксиде азота нет атомов водорода (zH АТ = 0), и второе слагаемое просто обнуляется.
Остаётся сделать проверку
Расчёт массового состава необходимо сделать отдельно для горючего и для окислителя.
На сегодня всё. Думаю для первого урока достаточно. В следующий раз мы с Вами определим стехиометрическое соотношение компонентов, поговорим о коэффициенте избытка окислителя и получим условную формулу топлива.
Удачи!
| Урок 02. Определение параметров топлива (ч.1) | » |


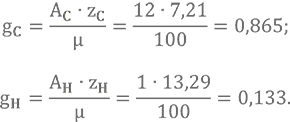


Если составить расчет для керосина СH1.956, подобный тому, который представлен в примере 2, то проверка покажет, что массовые доли неверно определены
Уважаемая Svetlana, хотелось бы увидеть более подробные рассуждения, чтобы прокомментировать Ваше замечание…